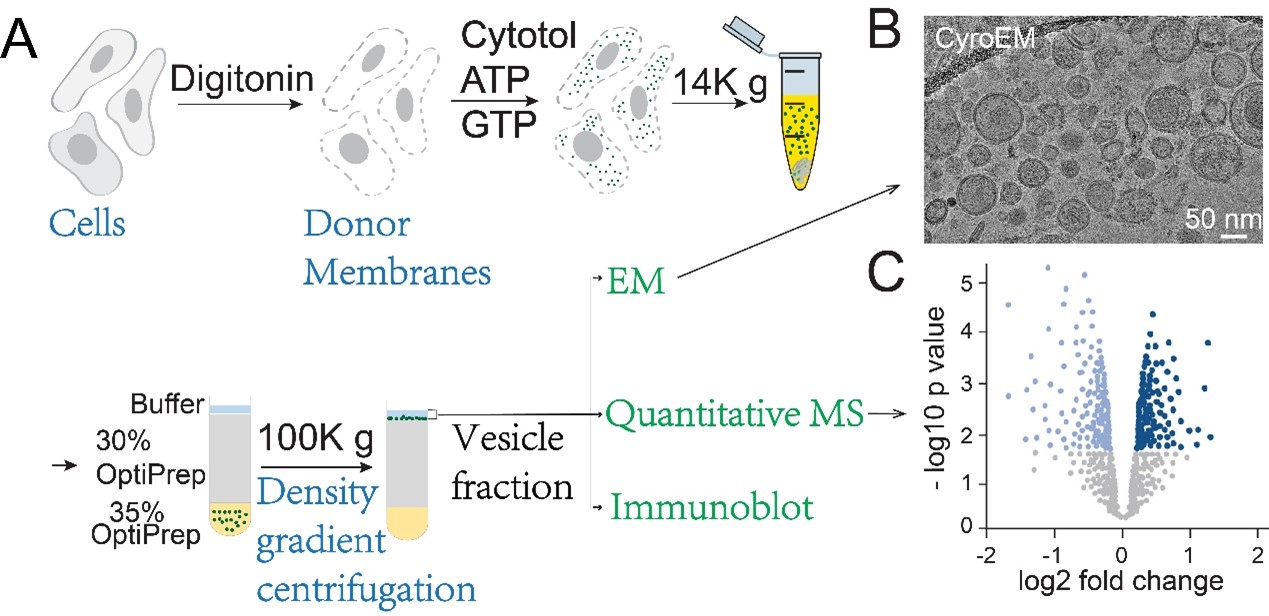
香港科技大学(科大)生命科学部副教授郭玉松教授领导的研究团队在理解细胞如何管理蛋白质内部运输的机制上取得重大突破。此运输过程不仅对维持生命至关重要,还与多种遗传性疾病关系密切。通过利用创新的囊泡蛋白质组学平台进行分析,研究团队有系统地识别与两种关键细胞运输复合体AP-1和AP-4相关的新型运送蛋白及其关键辅助因子。该项研究成果已于国际知名期刊《美国国家科学院院刊》(PNAS)上发表,研究团队将创新的体外囊泡重组技术及定量质谱基质蛋白组学相结合,成功绘制出前所未见运送蛋白与调控因子的完整图谱。
分泌运输路径如同细胞的「邮政服务」,确保蛋白质能够准确地送到正确的目的地,以维持细胞的正常功能。这个系统一旦出现错误,便可能导致严重的生理缺陷。
郭教授表示:「长久以来,科学界一直致力于全面绘制适配复合体如AP-1及AP-4的运送蛋白组,这些复合体的功能失常与MEDNIK综合症、X染色体相关智力障碍及AP-4缺陷综合症等严重遗传疾病有直接关係。」
郭教授进一步解释:「我们的研究透过在体外重构运输过程,并应用定量蛋白组学,开辟了全新的研究领域。这方法让我们能够直接识别出需要依赖AP-1或AP-4将其包装到囊泡中的蛋白质,从分散和零碎的认知转向对其运输全貌的整体性掌握。这揭示了新的客户蛋白,以及AP-4所依赖的、意想不到的细胞机制。」
该团队的创新方法将体外囊泡重组与定量质谱分析技术相结合,让研究人员能够在受控的环境中建立运输囊泡,并对其蛋白质组成进行全面分析。此项研究与香港理工大学姚锺平教授团队合作完成。
透过此方法,研究人员识别出依赖AP-1或AP-4运输的特定运送蛋白,这些蛋白从细胞内的中央分选枢纽——高尔基体的反面网络运输。他们确认,蛋白质CAB45为依赖AP-1的货物,而ATRAP(一种I型血管紧张素II受体相关蛋白)则是AP-4的一种新型货物。
此研究解开一项长期悬而未决的科学难题,即AP-4运输复合体如何在无须依赖网格蛋白(clathrin)的情况下,形成运输囊泡。团队发现两种细胞质因子WDR44与PRRC1在AP-4介导囊泡运输中发挥关键作用。当这些因子被抑制时,AP-4负责运输的关键运送蛋白(如ATG9A与ATRAP)将无法离开细胞器,导致细胞自噬(autophagy)等功能缺陷。
郭教授强调:「本研究不仅揭露了AP-1与AP-4的新型货物及必需辅助因子,更为科学界提供强大工具组,可系统性地深入解析囊泡运输机制,为探究相关疾病的病理机制及潜在治疗靶点开辟新路径。」
该研究的共同通讯作者为科大郭玉松教授与理大姚锺平教授,第一作者为科大博士后研究员彭子晴博士。
关于香港科技大学
香港科技大学(科大)(https://www.hkust.edu.hk/) 是国际知名的大学,致力推动创新教学、卓越研究及具影响力的知识转移。 科大着重为学生提供全面及跨学科的教学,于《2026年 QS 亚洲大学排名》中排行第六,《泰晤士高等教育全球年轻大学排名榜2024》中排行第三,并在《泰晤士高等教育大学影响力排名2025》中全球排第19、全港第一。另有13个科目跻身《2025年QS世界大学学科排名》全球50强,其中数据科学及人工智能学科全球排名第17位,蝉联本地大学之冠。此外,科大在全球大学就业能力排名中,一直位处全球首30名以内,反映毕业生极具竞争力。在研究及创业创新方面,逾八成的科大研究,于香港的大学教育资助委员会最新的「2020研究评审工作」被评为「国际卓越」或「世界领先」水平。截至2025年7月,科大成员共创立了逾1,900间至今活跃的初创公司,当中包括10间独角兽企业和17间成功退场的公司(上市集资或被并购)。